|
||||||||
|
近日,上海大学生命科学学院助理研究员陈雪与上海交大医学院刘俊岭教授团队及黄传新教授团队合作,在Nature Communications杂志发表题为“The phosphatase PTEN links platelets with immune regulatory functions of mouse T follicular helper cells”的研究论文,揭示了血小板PTEN分子在Tfh细胞分化与自身免疫反应中的调控功能。上海大学为本论文的第一作者单位。
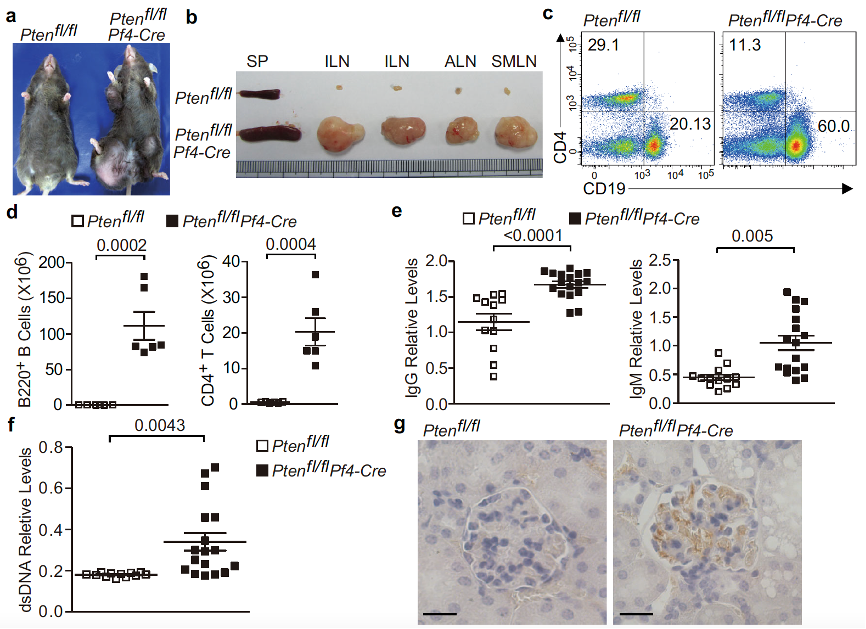
血小板除了参与血栓止血的病理生理过程外,还可调节多种固有免疫和适应性免疫细胞功能进而调控炎症与免疫反应。临床中多种自身免疫疾病,如系统性红斑狼疮、类风湿性关节炎等均存在血小板活化异常,而过度活化血小板调控自身免疫疾病的分子机制仍有待于进一步探索。 明星分子PTEN(Phosphatase and tensin homolog)是重要的抑癌基因,研究团队前期工作揭示PTEN可通过抑制PI3K/AKT信号通路进而抑制血小板的活化和聚集。因此,血小板特异缺失PTEN(Ptenfl/flPf4-Cre)小鼠可作为体内研究过度活化血小板功能的理想小鼠模型。 在这项工作中,陈雪及合作团队发现血小板特异缺失PTEN小鼠自发发生淋巴增生性与自身免疫性疾病,包括淋巴结与脾脏肿大、T/B淋巴细胞过度增殖、血浆中IgM/IgG及dsDNA抗体的增加,以及肾小球IgG的沉积等(图1)。进一步研究发现,Ptenfl/flPf4-Cre小鼠淋巴组织中过度的活化T细胞、Tfh细胞与生发中心反应导致机体免疫稳态失衡。
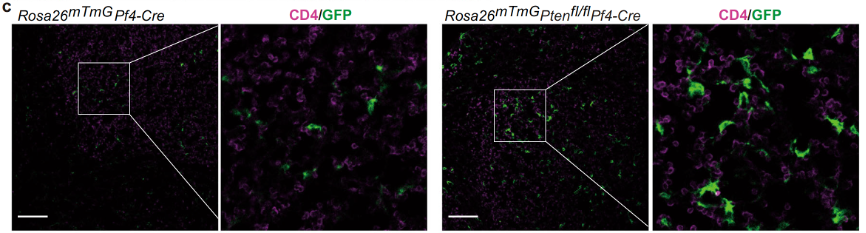
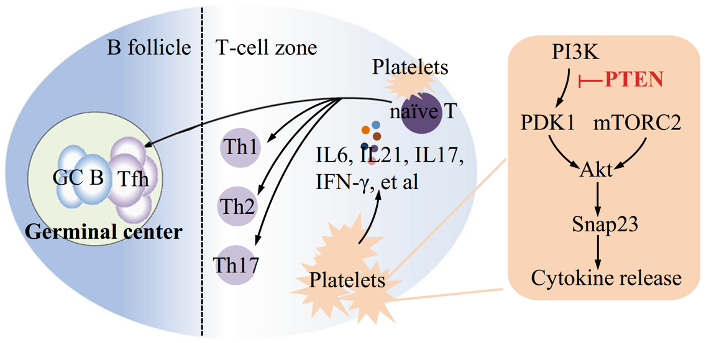
图1.Ptenfl/flPf4-Cre小鼠发生年龄相关的自身免疫疾病与淋巴增生。 机制上,PTEN缺失血小板过多的浸润到淋巴组织中,并通过与CD4+T细胞直接的相互作用,促进CD4+T细胞向Tfh细胞转化(图2)、GC B细胞过度增殖与生发中心过度反应等;PTEN缺失通过PDK1/mTORC2-AKT-SNAP23信号通路调控血小板分泌多种促Tfh细胞因子,如IL6,IL21,IL17与IFN-γ等(图3),最终导致免疫稳态失衡,促进自身免疫疾病的发生发展。
图2. PTEN缺失血小板浸润到淋巴组织中,形成“Platelet-CD4+T”细胞聚集体。
图3.血小板PTEN调控Tfh细胞反应的机制示意图。 该研究工作发现了PTEN在血小板介导的免疫稳态中的调控作用,并阐明了过度活化状态的血小板在自身免疫疾病中的重要调控功能与作用机制。同时,血小板与Tfh细胞的Link将为自身免疫疾病的治疗提供新思路与药物靶点,具有潜在的临床研究与应用价值。 上海大学生命学院助理研究员陈雪是本研究论文的第一作者,此论文是该团队继Blood论文揭示PI3K/PDK1/AKT信号通路调控血小板活化与动脉血栓形成之后(https://pubmed.ncbi.nlm.nih.gov/23444402/),关于血小板PI3K/PTEN/AKT信号通路的另一新的血小板免疫调控功能的发现。此项研究得到上海交通大学医学院陈国强院士、上海市免疫学研究所沈蕾研究员、陈磊研究员、李福斌研究员的大力协助与支持。上海交通大学医学院刘俊岭研究员、黄传新研究员,和上海大学陈雪助理研究员为本文的共同通讯作者。 |
上一条:李根喜教授团队在JACS发表乳腺癌亚型分析新方法
下一条:李根喜教授团队在《Research》发表肿瘤发展评价策略的研究成果